La tasa de corrosión es controlada por diferentes factores como el pH, temperatura, potencial electroquímico, electrólitos, así como también el método de control de corrosión aplicado. Estos factores en conjunto hacen que la evaluación del método de control de corrosión sea más complejo y consuma más tiempo.
Como todos saben, la corrosión es una reacción electroquímica. El concepto de resistencia eléctrica nos dice que, a mayor resistencia eléctrica, la corriente es más baja, y eso conlleva a una tasa menor de corrosión. La resistencia eléctrica en general consiste en componentes como resistencias, condensadores e inductores. Si teóricamente tenemos un buen modelo para analizar la resistencia, somos capaces de distinguir cuál componente de la resistencia es el elemento dominante, así como descubrir cuál es la raíz del sistema fallido.
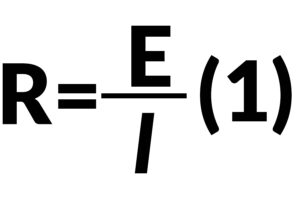 |
La ecuación de la ley de Ohm (1) solamente aplica para circuitos de resistencia simples, los cuales no dependen de la frecuencia ni consideran la fase de cambio para la corriente alterna. Para obtener mayor información sobre resistencias de circuito (para componentes tales como condensadores e inductores), que será llamada impedancia para ser precisos, la señal de excitación aplicada es potencial de CA con rango de frecuencia también.
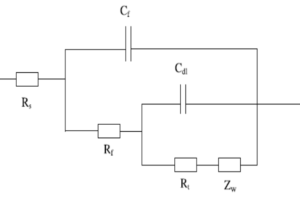
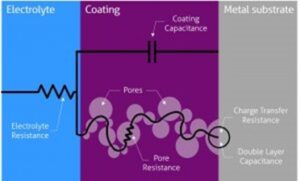
Podemos usar el modelo de circuito equivalente que mostramos en la Figura 1 y Figura 2 para analizar un metal con recubrimiento en condiciones corrosivas. Dónde Rs es resistencia de la solución, Rƒ es la resistencia de la película de recubrimiento; Cƒ es la capacidad de la película de recubrimiento; Rt es la resistencia de transferencia de carga; Cdl es la capacidad de la doble capa; Zw la impedancia Warburg o impedancia de difusión. Cada uno es analizado más adelante en este artículo.
|
|
|
La resistencia de solución o resistencia electrolítica Rs es un significante factor en la impedancia de una célula electroquímica. La resistencia de la solución electrolítica depende de los tipos de iones, concentración, temperatura y geometría de la superficie del electrodo. Por ejemplo, el agua Desionizada (DI) tiene mayor resistencia electrolítica que una solución salina. La resistencia de la solución es a menudo leída de la Trama de Nyquist (el valor real del eje en la intercepción de alta frecuencia) en la Figura 3.
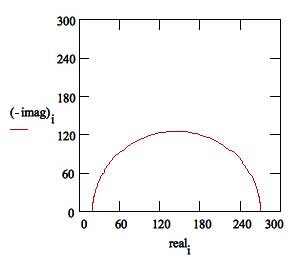
La resistencia de transferencia de carga Rt, cuando un metal está en contacto con un electrolito, el metal se oxidiza, así que los electrones dejan el metal, y los iones metálicos se dispersan en el electrolito; Durante este proceso, una carga es transferida. La resistencia de carga transferida es mayormente controlada por las reacciones cinéticas, temperatura, la concentración del reactivo y productos reacción, y el potencial. Algunas veces, los investigadores removerán la solución para minimizar el gradiente de concentración del reactivo/producto de reacción entre el gradiente entre granel y superficie metálica para estudiar las cinéticas de transferencia de carga.
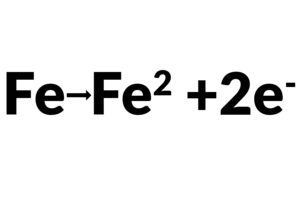 |
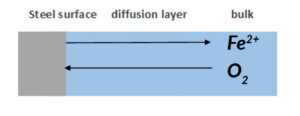
La impedancia Warburg o de Difusión Zw, es la impedancia que evalúa la transferencia de masa de especies de granel a superficie metálica. Como se mencionó anteriormente, siempre hay un gradiente de concentración entre granel y superficie metálica. Por lo tanto, la impedancia Warburg depende mayormente en que tan rápido el ion metálico puede ser transferido de la superficie metálica a la solución de granel, y que tan rápido el oxidante puede transferirse del granel a la superficie metálica para consumir los electrones (Figura 4). Al mismo tiempo, la impedancia Warburg también depende en la frecuencia de la perturbación potencial aplicada. Bajo frecuencia baja, los reactivos necesitan viajar más lejos para obtener una reacción, la cual aumenta la impedancia Warburg, y viceversa con alta frecuencia.
|
|
La capacidad de recubrimiento Cƒ es normalmente usada para evaluar la protección de recubrimientos orgánicos o capas hidrofóbicas que se forman sobre la superficie. La capacidad depende del tamaño de la superficie, constantes dieléctricas del material, y la distancia entres dos platos, que es el espesor del recubrimiento. A temperatura ambiente, el agua desionizada (DI) tiene una constante dieléctrica de 80, mientras que la mayoría de los recubrimientos orgánicos tienen una constante dieléctrica menor a 10. La capacidad de recubrimiento cambiada normalmente significa que el recubrimiento ha absorbido agua o tiene algún defecto generado. Un defecto típico es el poro generado en el recubrimiento, lo que proporciona caminos adicionales para los reactivos y electrones
Capacidad de Doble Capa Cdl
Una doble capa típica en la superficie del acero está construida por la absorción de moléculas de H₂O en la interfaz del metal/solución. El metal cargado es separado de los iones cargados por una función espacial aislante como una capacidad. Esta doble capa es afectada por un potencial de electrodo de circuito abierto, temperatura, concentraciones iónicas, tipos de iones, capas oxidadas, rugosidad del electrodo, y adsorción de impurezas. La existencia de oxígeno, y dióxido de carbono también pueden apartar la doble capa y causar una disminución en la capacidad de la doble capa. El espesor de la doble capa está en el orden de los angstroms. En la célula real, la doble capa suele estar en la doble capa que no siempre es un condensador ideal, y siempre es tratado como una constante empírica.
Referencias
BonnelA, y DabosiF. (1983). Corrosion Study of a Carbon Steel in Neutral Chloride Solutions by Impedance Techniques. Journal of the Electrochemical Society, 753-763.
Gamry. (n.d.). Basics of Electrochemical Impedance Spectroscopy. Retrieved from https://www.gamry.com/application-notes/EIS/basics-of-electrochemical-impedance-spectroscopy/
HongT, SunY.H, & JepsonW.P. (2002). Study on Corrosion Inhibitor in Larger Pipeline under Multiphase Flow using EIS. Corrosion Science, 101-112.
ZhengYougui. (2015). Electrochemical Mechanism and Model of H₂S Corrosion of Carbon Steel. Athens: Ohio University.